تخيل أن لديك بالونين متساويين في الحجم، أحدهما مليء بغاز الهيدروجين والآخر مليء بغاز الأكسجين. إذا كانت درجة الحرارة والضغط داخل البالونين متساويين، فما الذي يمكنك قوله عن عدد الجزيئات الموجودة في كل بالون؟ الجواب يكمن في قانون أساسي في الكيمياء، وهو قانون أفوجادرو.
ما هو قانون أفوجادرو؟
ينص قانون أفوجادرو على أن: “عند نفس درجة الحرارة والضغط، فإن أحجامًا متساوية من الغازات المختلفة تحتوي على عدد متساوٍ من الجزيئات.”
بمعنى آخر، إذا أخذنا حجمًا معينًا من غاز الهيدروجين وحجمًا مساويًا من غاز الأكسجين في نفس الظروف من الضغط ودرجة الحرارة، فسنجد أن عدد جزيئات الهيدروجين يساوي عدد جزيئات الأكسجين تمامًا.
الشرح المبسط للقانون
لتوضيح هذا القانون بشكل أبسط، تخيل أن الغاز يتكون من جسيمات صغيرة جدًا (جزيئات) تتحرك بشكل عشوائي في جميع الاتجاهات. عندما يكون الضغط ودرجة الحرارة ثابتين، فإن متوسط المسافة بين هذه الجسيمات يكون متساويًا بغض النظر عن نوع الغاز. وبالتالي، فإن حجم معين من أي غاز سيحتوي على نفس عدد الجسيمات.
الصيغة الرياضية للقانون
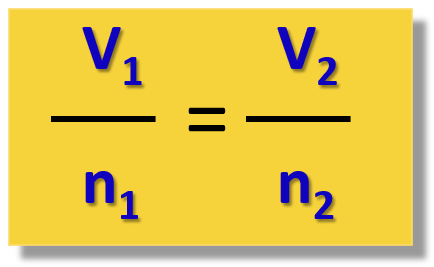
يمكن تمثيل قانون أفوجادرو رياضيًا بالعلاقة التالية:
V ∝ n
حيث:
- V: حجم الغاز
- n: عدد مولات الغاز
- ∝: يعني “يتناسب طرديًا مع”
هذه المعادلة تعبر عن أن حجم الغاز يتناسب طرديًا مع عدد مولات الغاز، طالما أن درجة الحرارة والضغط ثابتان.
أهمية قانون أفوجادرو
- تحديد الأوزان الجزيئية: يمكن استخدام قانون أفوجادرو لتحديد الأوزان الجزيئية للغازات المختلفة.
- حساب الكثافات: يمكن حساب كثافة الغاز باستخدام قانون أفوجادرو.
- فهم سلوك الغازات: يساعد قانون أفوجادرو في فهم سلوك الغازات وتطبيقه في العديد من العمليات الصناعية.
- تحديد حجم الغازات الناتجة عن التفاعلات الكيميائية: يمكن استخدام القانون لحساب حجم الغازات الناتجة عن تفاعل كيميائي معين.
العلاقة بين قانون أفوجادرو وقوانين الغازات الأخرى
يعتبر قانون أفوجادرو أحد القوانين الأساسية في دراسة الغازات، وهو مرتبط بقوانين أخرى مثل قانون بويل وقانون شارل وقانون الغاز المثالي. هذه القوانين مجتمعة تساعدنا على فهم سلوك الغازات في ظل ظروف مختلفة.
مثال على تطبيق قانون أفوجادرو
السؤال: إذا كان حجم 2 مول من غاز الأكسجين عند درجة حرارة وضغط معينين يساوي 44.8 لتر، فما هو حجم 3 مولات من غاز الهيدروجين في نفس الظروف؟ الحل: بما أن عدد المولات يتناسب طرديًا مع الحجم، فإن: (حجم الهيدروجين / حجم الأكسجين) = (عدد مولات الهيدروجين / عدد مولات الأكسجين) (حجم الهيدروجين / 44.8 لتر) = (3 مول / 2 مول) حجم الهيدروجين = (3/2) * 44.8 لتر = 67.2 لتر
الخلاصة
قانون أفوجادرو هو قانون أساسي في الكيمياء يربط بين حجم الغاز وعدد الجزيئات الموجودة فيه. هذا القانون يساعدنا على فهم سلوك الغازات وتطبيقه في العديد من المجالات.
الكلمات المفتاحية: قانون أفوجادرو، الغازات، الجزيئات، المولات، الحجم، الضغط، درجة الحرارة